Die Entdeckung des Grün Fluoreszierenden Proteins, kurz GFP, aus der Qualle Aequorea victoria hat die Molekularbiologie grundlegend verändert. Dank seiner Fluoreszenz können wir heute in lebenden Zellen beobachten, wie Proteine sich bewegen, miteinander interagieren und auf Reize reagieren. Daher möchte ich in diesem Text dieses eigentlich unscheinbare Protein näher beleuchten und zeigen, wie es so unverzichtbar für die moderne Molekularbiologie geworden ist.

Einschub: Fluoreszenz und Lumineszenz
Bevor wir so richtig anfangen, möchte ich noch ganz kurz klären, was Fluoreszenz und Lumineszenz sind (falls ihr das sowieso schon wisst, dann überspringt diesen Absatz doch einfach): Fluoreszenz ist die Eigenschaft von Molekülen, Licht einer bestimmten Wellenlänge – also einer bestimmten Farbe – zu absorbieren und Licht mit einer größeren Wellenlänge abzugeben. (Bio-)Lumineszenz dagegen benötigt kein Anregungslicht, sondern nutzt chemische Reaktionen zur Lichterzeugung.
GFP unterm Mikroskop
Wieso sollte ein Protein wie GFP, auch wenn es leuchten kann, ein ganzes Wissenschaftsgebiet revolutionieren? Es ist auf jeden Fall nicht die Fluoreszenz allein. Denn genauso wichtig ist, dass man andere Proteine ziemlich einfach damit markieren kann.
Man kann nämlich sogenannte Fusionsproteine herstellen, die aus GFP und einem anderen Protein bestehen, das man gerne untersuchen möchte. Solche Fusionsproteine sind wie jedes andere Protein auch genetisch codiert. Wird das entsprechende Gen in eine Zelle eingebracht, stellt sie das fluoreszierende Fusionsprotein her. Und was man damit jetzt anstellen kann, macht GFP zu dem Game Changer, der es ist.
Unter einem Fluoreszenzmikroskop betrachtet fluoresziert dann nicht einfach nur die ganze Zelle. Nein, das Leuchten ist nur dort zu finden, wo sich das zu untersuchende Protein befindet. Damit kann man also die Lokalisation von Proteinen in einer Zelle erkennen. Und nicht nur das: Beobachtet man die Zelle über einen längeren Zeitraum, kann man auch die Bewegung von Proteinen durch die Zelle in Echtzeit beobachten – z.B. wenn ein Membranprotein aus der Zellmembran wieder ins Innere der Zelle aufgenommen wird.


Die Fluoreszenzmarkierung von Proteinen ermöglicht jedoch nicht nur solche „einfache“ Fluoreszenzmikroskopie, sondern auch diverse Techniken der super resolution microscopy. Das sind Formen der Fluoreszenzmikroskopie, bei der Strukturen aufgelöst werden können, die kleiner sind als die eigentliche Auflösungsgrenze. Mithilfe geschickter Techniken und des richtigen Fluorophors kann dieses Abbe-Limit für die minimale Auflösung dennoch überwunden werden, bis hin dazu, dass sogar einzelne Proteine beobachtet werden können.
Nicht nur Mikroskopie
Fluoreszenzproteine sind nicht nur in der Mikroskopie unverzichtbar, sondern finden auch in anderen Techniken breite Anwendung. Beispielsweise kann man mit einer FRET genannten Technik mit zwei unterschiedlichen Fluoreszenzproteinen messen, ob zwei Proteine miteinander interagieren, indem man sie jeweils mit einem anderen Fluoreszenzprotein markiert. Wenn die Proteine nahe genug zusammenkommen, überträgt das eine Fluoreszenzprotein seine Energie auf das andere, wodurch dieses ebenfalls zu leuchten beginnt. Auf diese Weise kann die Interaktion der Proteine sichtbar gemacht und gemessen werden – allein durch ihre Fluoreszenz!
Man kann fluoreszierende Proteine auch hervorragend als Reporter einsetzen. Ohne jetzt zu sehr ins Detail zu gehen, werden solche Reporter-Assays verwendet, um die Expression oder Funktion eines anderen Gens zu untersuchen. Das Fluoreszenzprotein berichtet – engl. to report – also über ein anderes Gen, Protein etc.
Ich will nochmal betonen, dass das alles in lebenden Zellen funktioniert. Wir können also wortwörtlich zuschauen oder über Techniken wie FRET messen, wie sich Biomoleküle in der Zelle bewegen, miteinander interagieren und auf Reize reagieren. Das müssen allerdings auch keine einzelnen Zellen in der Zellkultur sein – nein, Fluoreszenzproteine werden auch zur Forschung in komplexen Organismen wie beispielsweise Mäusen verwendet.
GFP – Eine Entdeckung aus dem Meer
GFP stammt ursprünglich aus einer Quallenart namens Aequorea victoria, die im Pazifischen Ozean lebt. Was GFP zum großen Durchbruch verholfen hat, ist vor allem seine Einfachheit. Es formt eine stabile Struktur, die β-Fass genannt wird und, naja, fassförmig ist. Im Inneren dieses Fasses liegt der eigentliche fluoreszierende Teil von GFP, das Fluorophor. Dieses Fluorophor bildet sich von selbst aus den Seitenketten der Aminosäuren, aus denen das GFP besteht. Es braucht also weder irgendwelche Cofaktoren oder sonstige zusätzliche Stoffe noch muss es von Enzymen erst zum richtigen Fluorophor umgesetzt werden, sondern funktioniert von ganz allein. Dadurch kann GFP in quasi jeder Zelle ohne Probleme exprimiert werden, ohne dass man sich Gedanken darüber machen muss, ob diese Art von Zellen überhaupt geeignet ist.
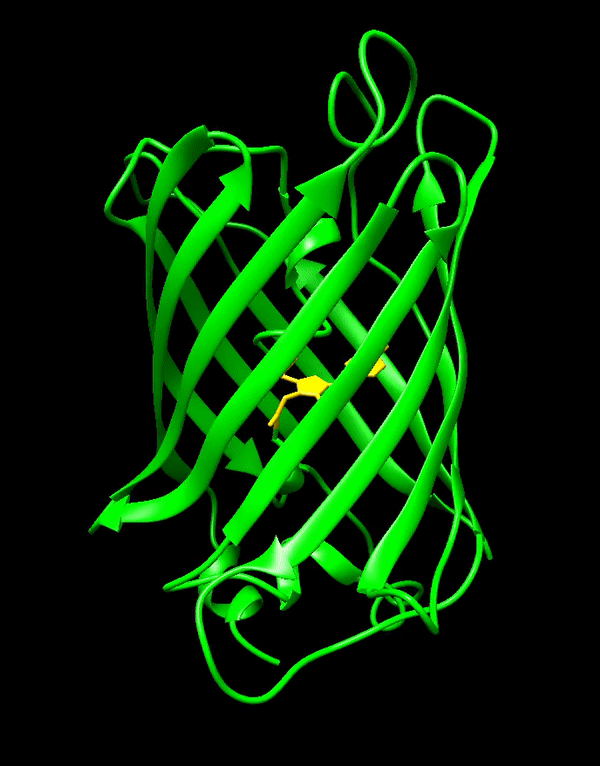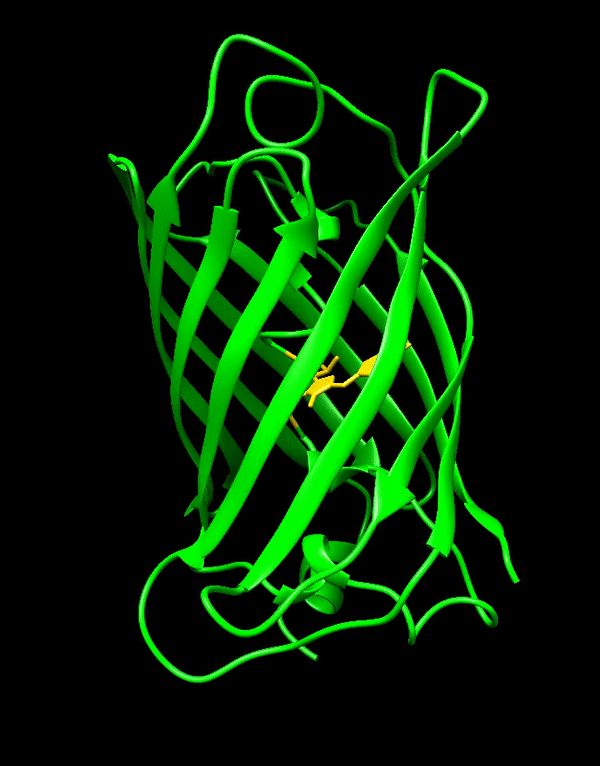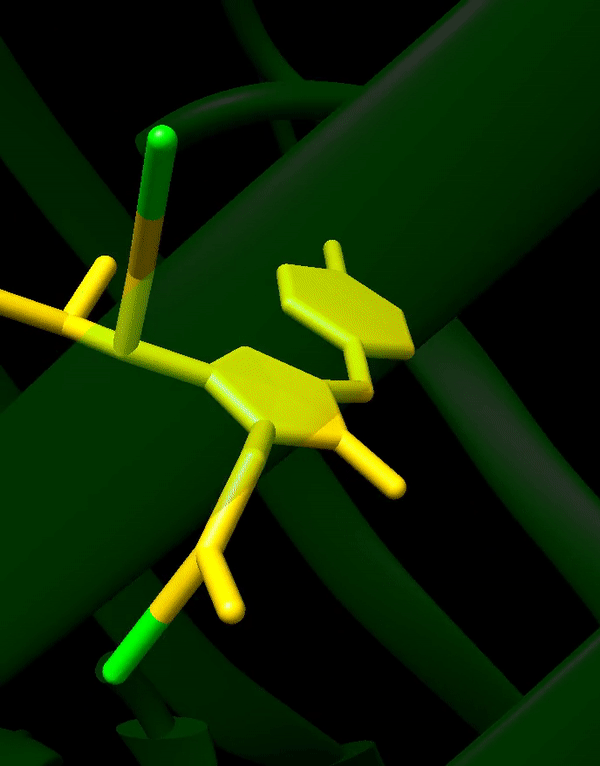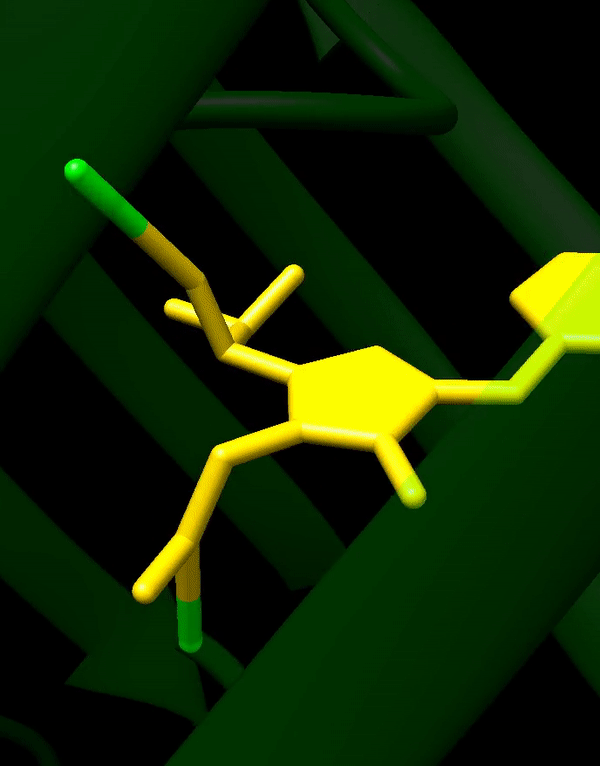
Da GFP und Fluoreszenzproteine im Allgemeinen so wichtig sind, ist es wohl nicht überraschend, dass es für die Entdeckung von GFP im Jahr 1962 und dessen Weiterentwicklung auch einen Nobelpreis gab. Aber seit 1962 ist viel passiert – wobei seit den Neunzigern wohl passender wäre, weil das GFP-Gen erst dann kloniert und GFP auch erst danach richtig charakterisiert wurde.
Inzwischen gibt es unzählige Fluoreszenzproteine, die von GFP abgeleitet sind. Sie fluoreszieren in anderen Wellenlängen als GFP, sind stabiler oder sind sogar an- bzw. abschaltbar. Außerdem wurden auch andere Fluoreszenzproteine entdeckt und daraus wiederum modifizierte Versionen hergestellt, so dass heutzutage eine Unmenge an Fluoreszenzproteinen zur Verfügung stehen, je nachdem, was für ein bestimmtes Experiment gerade benötigt wird.
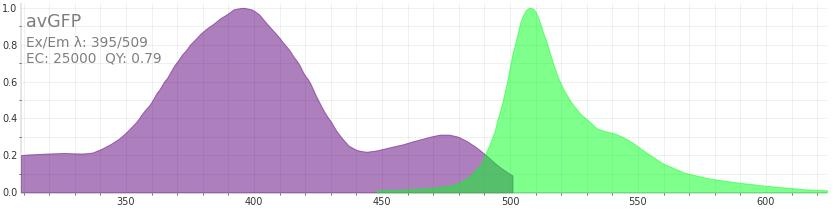
Ähnlich wie die Fluoreszenzproteine oder in Kombination mit ihnen können auch small molecule-Fluoreszenzfarbstoffe verwendet werden. Das sind keine großen Biomoleküle wie Proteine, sondern kleine organische Moleküle. Im Vergleich zu den Fluoreszenzproteinen bieten sie einige bestimmte Vor- und Nachteile. Im Allgemeinen ist es aber deutlich aufwändiger, ein Protein damit zu markieren. Statt ein genetisch codiertes Fusionsprotein verwenden zu können, müssen sie z.B. mithilfe von Click-Reaktionen, die ich in meinem Text zum Chemie-Nobelpreis 2022 beschrieben habe, an dem Zielprotein befestigt werden.
Licht ins Dunkel bringen
Ich denke nicht, dass ich der Vielzahl von Anwendungen und Weiterentwicklungen von Fluoreszenzproteinen in diesem Text wirklich genüge tun kann. Aber hoffentlich habt ihr jetzt ein Gefühl dafür, wieso sie für die Biowissenschaften so unentbehrlich sind. Sie bringen im wahrsten Sinne des Wortes Licht ins Dunkel innerhalb von Zellen und ermöglichen es uns, Abläufe zu sehen – ob mit Messgeräten oder unseren eigenen Augen – die uns ansonsten verborgen geblieben wären. Alles dank der Quallen, die dieses tolle Werkzeug „für uns“ erfunden haben.
Bevor dieser Text zu Ende ist, möchte ich aber noch eine Sache erwähnen: Denn aufmerksame Lerser:innen werden sich vielleicht gefragt, woher in einer Qualle das Anregungslicht herkommt, das GFP ja braucht, um zu leuchten. Tatsächlich ist es so, dass GFP in den Quallen eben nicht durch Licht angeregt wird, sondern durch ein biolumineszentes Protein, das mithilfe von chemischen Reaktionen GFP anregen oder auch selbst Licht erzeugen kann.
Und eben solche biolumineszente Proteine werden in der molekularbiologischen auch verwendet. Hier sind es aber andere Tiere, die uns ihr Leuchten zur Verfügung gestellt haben. Häufig benutzte biolumineszente Proteine stammen nämlich aus Glühwürmchen oder auch Korallen.
—
Falls euch dieser Text gefallen hat, dann lest doch gerne auch den letzten Beitrag, empfehlt PharmBlog weiter oder abonniert meinen Newsletter, um keinen neuen Beitrag mehr zu verpassen.
Pingback:Wie die Erweiterung des genetischen Codes neue Arzneimittel ermöglicht - PharmBlog